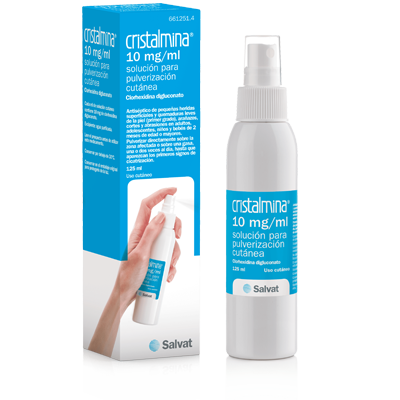
Cristalmina Film 30 gr.
Regístrate para ver precios
Descripción
Ficha Técnica de Cristalmina Film 10 mg/g Gel
1. NOMBRE DEL MEDICAMENTO
Cristalmina film 10 mg/g gel
2. COMPOSICIÓN CUALITATIVA Y CUANTITATIVA
Cada g de gel contiene 10 mg de digluconato de clorhexidina.
Excipiente con efecto conocido: Cada g de gel contiene 20 mg de alcohol bencílico.
Para consultar la lista completa de excipientes, ver sección 6.1.
3. FORMA FARMACÉUTICA
Gel.
Gel transparente, incoloro o ligeramente amarillento.
4. DATOS CLÍNICOS
4.1. Indicaciones terapéuticas: Antiséptico de heridas y quemaduras leves de la piel. Antiséptico del ombligo en recién nacidos.
4.2. Posología y forma de administración: Aplicar una o dos veces al día. No realizar más de dos aplicaciones diarias del producto.
4.3. Contraindicaciones: Hipersensibilidad al principio activo o a alguno de los excipientes. No utilizar en ojos, oídos, ni en el interior de la boca u otras mucosas.
4.4. Advertencias y precauciones especiales de empleo: Uso externo sobre la piel. No ingerir. En caso de contacto accidental con ojos u oídos lavar inmediatamente con abundante agua. No debe utilizarse en caso de heridas profundas y extensas.
5. PROPIEDADES FARMACOLÓGICAS
5.1. Propiedades farmacodinámicas: Antiséptico con efectividad contra gram-positivos y gram-negativos.
5.2. Propiedades farmacocinéticas: La absorción de clorhexidina a través de la piel es mínima.
6. DATOS FARMACÉUTICOS
6.1. Lista de excipientes: Alantoína, alcohol bencílico, hidroxipropilmetilcelulosa, agua purificada.
6.2. Incompatibilidades: La clorhexidina es incompatible con jabón y otros agentes detergentes aniónicos.
6.3. Periodo de validez: 3 años.
6.4. Precauciones especiales de conservación: Conservar por debajo de 25 ºC.
6.5. Naturaleza y contenido del envase: Tubo de aluminio con boca ciega, provisto de tapón a rosca. Presentaciones de 30 g y de 100 g.
7. TITULAR DE LA AUTORIZACIÓN DE COMERCIALIZACIÓN
Laboratorios Salvat, S.A., C/Gall, 30-36, 08950 Esplugues de Llobregat, Barcelona, España.
8. NÚMERO(S) DE AUTORIZACIÓN DE COMERCIALIZACIÓN
61.110
9. FECHA DE LA PRIMERA AUTORIZACIÓN/ RENOVACIÓN DE LA AUTORIZACIÓN
Fecha de la primera autorización: 29 de abril de 1996
Fecha de la última revalidación: 29 de abril de 2006
Para más detalles, consultar la página web de la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).